Cette mémoire est réalisée par NAHLI Med & ATIF Oussama
Flière SVI Licence Fondamentale
Faculté des Sciences Tétouan ¦ Département de Biologie
! Allons y !
|
Universté Abdelmalek Essaâdi
|

|
Faculté des Sciences Tétouan
|
|
Filière : Sciences de la Vie
|
Mémoire de Fin d’Etudes :
PATHOLOGIE INFLAMMATOIRE CHRONIQUE DES VOIES RESPIRATOIRES : L’ASTHME ALLERGIQUE
Présenté par :
NAHLI Mohamed & ATIF Oussama
Date de la soutenance :
30-06-2017
JURY
.
.
.
.
|
DEDICACE
|
A nos amis-es
A nos familles
A tous les Professeurs de département de Biologie
|
REMERCIEMENT
|
Nous tenons à remercier l’ensemble des membres du jury qui ont accepté d’évaluer ce travail : Monsieur le Professeur EL MTILI Nour Eddine et Monsieur le Professeur KHAY El Ouardy.
Monsieur le Professeur Mohamed MRANI ALAOUI, nous vous remercions d’avoir été notre directeur officiel de mémoire, nous vous remercions également pour votre disponibilité et les conseils que vous nous avez apportés tout au long de ce travail.
Nous tenons à remercier également monsieur le Docteur LOUTFI radiologue et spécialiste des maladies des voies respiratoire dans le centre de Croissant Rouge – Tétouan qui nous a aidé dans la parties du diagnostic (durant le mois mai 2017, par 5 séances). Merci pour la confiance que tu nous as témoigné et pour la rigueur de ton encadrement, tes conseils ainsi que pour ta disponibilité.
|
RESUME
|
L’asthme allergique est défini d’une part par une inflammation chronique des voies aériennes et d’autre part par une hyperréactivité bronchique responsable des symptômes caractéristiques de la maladie que sont les sifflements, la toux et la dyspnée.
L’asthme est une maladie multifactorielle résultant d’interactions entre de multiples facteurs génétiques et environnementaux.
La prévalence de l’asthme est en augmentation avec le temps. Elle touche davantage les habitants des pays développés que ceux des pays sous-développés, et c’est à cause de la présence des agents déclenchants (exposition à des allergènes inhalés, toxiques comme les isocyanates, infections virales…) et de la pollution atmosphérique.
L’induction d’une immunité implique la génération de réponses distinctes du système immunitaire : la lutte contre les pathogènes intracellulaires est associée à l’activation des macrophages et des lymphocytes (réponse Th1); La défense antiparasitaire est liée à la production d’IgE spécifiques et à une inflammation à éosinophiles (réponse Th2).
Mots-clés : Asthme ; Allergie ; Hyperréactivité bronchique ; Inflammation
|
LISTE DES ABREVIATIONS
|
Les abréviations sont ici définies au singulier, mais sont utilisées dans ce manuscrit au singulier et au pluriel, indifféremment.
|
Sigle
|
Signification
|
|
AINS
|
Anti inflammatoires non stéroïdiens
|
|
AIR
|
Asthma Insight and Reality
|
|
AIRMAG
|
AIR Maghreb
|
|
BPCO
|
broncho-pneumopathie chronique obstructive
|
|
BT
|
bronchioles terminales
|
|
CCL
|
C-C Motif Chemokine Ligand
|
|
CCR
|
C-C chemokine receptor
|
|
CD
|
classe de différenciation
|
|
CMH
|
complexe majeur d’histocompatibilité
|
|
CRTH2
|
chemoattractant receptor-homologous molecule expressed on TH2
|
|
CTLA-4
|
cytotoxic T-lymphocyte antigen-4
|
|
CTR
|
Ctype lectin receptors
|
|
DC
|
cellules dendritiques
|
|
ECP
|
Eosinophil Cationic Protein
|
|
ECP
|
eosinophil cationic protein
|
|
ECRHS
|
European Community Respiratory Health Survey
|
|
EDN
|
eosinophil-derived neurotoxin
|
|
EFR
|
Epreuve fonctionnelle respiratoire
|
|
EP
|
eosinophil peroxydase
|
|
EPO
|
Eosinophil Peroxydase
|
|
Fc
|
fragment cristallisable
|
|
Foxp3
|
forkhead box protein 3
|
|
GITR
|
glucocorticoid-induced tumor necrosis factor receptor
|
|
GM-CSF
|
Granulocyte Colony Stimulating Factor
|
|
GM-CSF
|
Granulocyte Macrophage Colony Stimulating Factor
|
|
HRB
|
hyperréactivité bronchique
|
|
IEC
|
inhibiteur de l’enzyme de conversion
|
|
IFN
|
Interferon
|
|
IgE
|
Immunoglobuline E
|
|
IL
|
Interleukine
|
|
iNK-T
|
lymphocyte NK invariant
|
|
ISAAC
|
International Study of Asthma and Allergies in Childhood
|
|
LT
|
Leukotriene
|
|
LTC4
|
Leukotriene C4
|
|
MBP
|
Major Basic Protein
|
|
MBP
|
major basic protein),
|
|
MPOC
|
la maladie pulmonaire obstructive chronique
|
|
NK
|
natural killer
|
|
NOD
|
Nucleotide Oligomerization Domain
|
|
OMS
|
Organisation Mondiale de la Santé
|
|
PAMP
|
Pathogen Associated Molecular Patherns
|
|
PAR
|
protease-activated receptors
|
|
PCNA
|
proliferating cell nuclear antigen
|
|
PGD
|
prostaglandine D
|
|
PNN
|
Polynucléaire neutrophile
|
|
PRR
|
Pattern Recognition Receptors
|
|
STAT
|
Signal transducer and activator of transcription
|
|
TDM
|
Tomodensitométrie
|
|
TGF
|
transforming growth factor
|
|
TGF
|
transforming growth factor
|
|
Th
|
T CD4+ helper
|
|
TLR
|
Toll-like receptors
|
|
TNF
|
Tumor necrosis factor
|
|
TSLP
|
thymic stromal lymphopoietin
|
LISTE DES FIGURES
Figure 1 : Prévalence de l’asthme à Tétouan – Maroc ……………………………………………4
Figure 2 : Distribution de l’asthme professionnel en fonction du métier ………………………5
Figure 3 : stéthoscope ………………………………………………………………………………………7
Figure 4 : Spiromètre portable moderne …………………………………………………………………8
Figure 5 : Spiromètre ………………………………………………………………………………………8
Figure 6 : Photographie du thorax standard ………………………………………………………….9
Figure 7 : Photographie du poumon pris par le scanner …………………………………………..10
Figure 8 : Schéma représentatif de l’appareil respiratoire chez l’Homme ……………………..11
Figure 9 : Coupe longitudinale d’une cavité nasale de l’Homme ……………………………………12
Figure 10 : Schéma simplifié présente segmentation bronchique. ……………………………………13
Figure 11 : Représentation schématique des alvéoles ………………………………………………….14
Figure 12 : La paroi des voies aériennes ………………………………………………………………..17
Figure 13 : Photographie en microscopie optique de cellules humaines bronchiques en culture distinguant une couche de mucus et le liquide périciliaire …………………………………………………………………18
Figure 14 : Initiation et entretien de la réaction inflammatoire dans l’asthme ………………………23
Figure 15: L’activation des mastocytes déclenche une réaction allergique ………………………31
Figure 16 : L’expression de CCR3, CRTH2, CCR4, CCR5, CCR8, CCR2 et CXCR1/CXCR2 sur les principaux acteurs cellulaires impliqués dans l’inflammation asthmatique ……………………….33
Figure 17: Rôle des lymphocytes Th2 dans la physiopathologie de l’asthme ………………..35
Figure 18 : Différents types d’activation T dans l’asthme …………………………………………….37
Figure 19: Coupe schématique d’une bronche d’un patient asthmatique ……………………….37
LISTE DES TABLEAUX
Table 1: phénotype d’asthme selon les régions chromosomiques ……………………………………..20
TABLE DES
INTRODUCTION ………………………………………………………………………………….1
I. L’asthme allergique …………………………………………………………………………..2
1. Définition et généralité ……………………………………………………………………2
2. Epidémiologie ………………………………………………………………………………….3
3. L’asthme chez l’adulte ……………………………………………………………………4
4. Signes et manifestations cliniques ……………………………………………………..6
5. Diagnostic ………………………………………………………………………………….7
II. Anatomie de l’appareil respiratoire de l’Homme ……………………………….11
1. Anatomie de l’appareil respiratoire …………………………………………………….11
2. Histologie de l’appareil respiratoire …………………………………………………….15
2.1 Musculeuse et tissu conjonctif ……………………………………………………………15
2.2 Epithélium et muqueuse …………………………………………………………………..16
III. Etiologie ………………………………………………………………………………………..18
1. Facteurs impliqués dans le développement et l’expression de la maladie …..18
1.1 Facteurs de l’hôte ………………………………………………………………………….19
1.2 Facteurs de l’environnement ……………………………………………………………20
1.3 Facteurs psychologique …………………………………………………………………..22
IV. Physiopathologie ………………………………………………………………………….22
1. Réaction inflammatoire asthmatique …………………………………………………….22
2. Hyperréactivité et obstruction bronchique ……………………………………………..34
V. Conclusion …………………………………………………………………………………38
Bibliographies ………………………………………………………………………………………..39
INTRODUCTION
L’asthme allergique est une maladie non transmissible, défini comme un syndrome inflammatoire chronique de la muqueuse bronchique qui touche les voies aériennes inférieures et notamment les bronches et qui apparaît après une période de latence (pour que s’installent les phénomène de sensibilisation) dans lesquels de nombreuses cellules jouent un rôle dans un processus en cascade qui cause à une constriction de ces bronches (broncho-constriction) responsable d’une diminution du débit aérien dans les voies respiratoires, ce qui conduit à l’apparition des crises récurrentes comme des difficultés respiratoire et une respiration sifflante et qui varient en gravité et en fréquence d’une personne à l’autre. Elle peut se manifester chez un grand nombre d’enfants et d’adultes dans le monde entier.
L’asthme est une maladie multifactorielle résultant d’interactions entre de multiples facteurs de l’hôte (génétique, psychologique) et environnementaux.
L’induction d’une immunité implique la génération de réponses distinctes du système immunitaire : la lutte contre les pathogènes intracellulaires est associée à l’activation des macrophages et des lymphocytes CD8+ (réponse Th1); la défense antiparasitaire est liée à la production d’IgE spécifiques et à une inflammation à éosinophiles (réponse Th2). Les lymphocytes CD4+ (TH0) empruntent en effet majoritairement deux grandes voies de différenciation définies par le profil de sécrétion cytokinique, les lymphocytes Th1 étant caractérisés par la production d’IL-2 et d’interféron (IFN), et les lymphocytes Th2 par celle d’IL- 4, d’IL-5 et d’IL-10. L’engagement dans une voie particulière de différenciation est déterminé par l’activation de facteurs de transcription spécifiques en réponse aux médiateurs principalement produits par les cellules présentatrices de l’antigène.
I. L’asthme allergique
1. Définition et généralité
Une maladie inflammatoire chronique conduit à la formation de lésions focalisées ou granulomes, (inflammation) qui pouvant toucher la plupart des organes et tissus du corps humain : système digestif, système nerveux, système respiratoire, épiderme, articulations… et qui pouvant aussi prendre des formes variables selon l’agent inducteur, la réponse immunitaire de l’hôte et la localisation tissulaire. Ces lésions sont caractérisées par la présence simultanée de nombreux types de cellules immunitaire.
Les maladies chroniques des voies respiratoires sont des maladies qui peuvent se manifester à tout âge (chez les enfants, les adolescents, les adultes et les aînés) et qui affectent les voies aériennes et d’autres parties du poumon. Parmi ces maladies on retrouve la maladie pulmonaire obstructive chronique (MPOC), le cancer du poumon, les allergies respiratoires, les pneumopathies professionnelles, l’hypertension artérielle pulmonaire, l’asthme…
L’asthme allergique est une maladie non transmissible, défini comme un syndrome inflammatoire chronique de la muqueuse bronchique qui touche les voies aériennes inférieures et notamment les bronches et qui apparaît après une période de latence (pour que s’installent les phénomène de sensibilisation) dans lesquels de nombreuses cellules jouent un rôle (en particulier les mastocytes, les éosinophiles et les lymphocytes T) (Godard et al., 2004) dans un processus en cascade qui cause à une constriction de ces bronches (broncho-constriction) responsable d’une diminution du débit aérien dans les voies respiratoires, ce qui conduit à l’apparition des crises récurrentes comme des difficultés respiratoire et une respiration sifflante et qui varient en gravité et en fréquence d’une personne à l’autre.
Elle peut se manifester chez un grand nombre d’enfants et d’adultes dans le monde entier.
2. Epidémiologie
2.1 A l’échelle mondiale
À l’échelle mondiale, la prévalence de l’asthme a augmenté au cours des 30 dernières années. Les dernières statistiques, selon l’Organisation Mondiale de la Santé (OMS), estime le nombre de sujets asthmatiques à 235 millions à travers le monde (OMS, 2017).
Les études internationales sur l’épidémiologie des allergies respiratoires ECRHS (European Community Respiratory Health Survey), ISAAC (International Study of Asthma and Allergies in Childhood) et AIR (Asthma Insight and Reality) ont révélé une augmentation de prévalence des allergies respiratoires dans le monde avec des différences considérables entre les pays, particulièrement élevée dans les pays anglophones et plus basse dans les pays méditerranéens et en Europe de l’Est (F.Bardei et al., 2016). Globalement, l’asthme touche davantage les habitants des pays développés que ceux des pays sous-développés.
La prévalence de l’asthme, ou des symptômes respiratoires liés à l’asthme, est plus élevée chez les enfants que chez les adultes (Sanchez, 2015).
2.2 Au MAROC
La prévalence de l’asthme au Maroc est de 8,5 à 12,5 % (F.Bardei et al., 2016).
Une étude réalisée dans la ville de Tétouan (F.Bardei et al., 2016) a évalué un échantillon de 379 patients, et elle a montré que la prévalence des patients asthmatiques est de 6.3%, avec 3.4% chez les femmes et 2.9% chez les hommes.
Figure 1 : Prévalence de l’asthme à Tétouan (6.3%) – Maroc
3. L’asthme chez l’adulte
L’asthme professionnel (AP) est la maladie respiratoire d’origine professionnelle la plus fréquente dans les pays industrialisés. Il s’agit d’une pathologie complexe dite « multifactorielle », résultant des relations et interconnexions d’un grand nombre de facteurs de risques génétiques, constitutionnels, comportementaux et environnementaux. L’asthme professionnel est attribuable à des agents présents dans l’environnement professionnel. Plus de 500 agents sont connus pour être impliqués dans le développement de l’AP et sont classés en deux catégories :
(1) agents de haut poids moléculaire (Les asthmes IgE dépendants résultent le plus souvent d’une sensibilisation a des molécules d’origine biologique surtout des protéines animales ou végétales agissant à travers un mécanisme IgE dépendant)
Et (2) agents de bas poids moléculaire (composés organiques et inorganiques généralement non associés à un mécanisme IgE dépendant) (Acouetey & Ardoin, 2012).
Parmi les principales substances allergisantes en cause sont : la farine, les isocyanates, les persulfates alcalins, les aldéhydes, le latex et les acariens. Et les professions les plus atteintes sont : les boulangers et les pâtissiers, les coiffeurs, les employés de nettoyage, les professions médicales et paramédicales, les peintres et les travailleurs du bois (M. El Yamani, 2003).
Figure 2 : Distribution de l’asthme professionnel en fonction du métier (J. Ameille, 2010) Exemple de France
Les boulangers pâtissiers :
Environ 20 % des asthmes professionnels sont observés chez les boulangers et les pâtissiers. Les farines de blé sont la principale cause.
Le personnel des métiers de la santé :
Environ 10 % des asthmes professionnels sont observés. Le latex des gants est la cause la plus souvent invoquée et également l’utilisation d’autres médicaments. D’autres produits désinfectants (oxyde d’éthylène, chloramine T) sont plus rarement mis en cause.
Les coiffeurs :
Environ 8 % des asthmes professionnels concernent les coiffeurs. Les cas sont dus en majorité aux persulfates alcalins.
Les peintres :
Les peintres représentent environ 8 % des victimes d’asthme professionnel. Les isocyanates entrant dans la composition des peintures et ils sont responsable de cette pathologie.
Les travailleurs du bois :
Représentent environ 5 % des victimes d’asthme professionnel. Le bois est la principale cause.
Les personnels de nettoyage :
4 à 5 % des asthmes professionnels concernent les personnels de nettoyage. Les causes : gants en latex, ammoniums quaternaires des détergents et beaucoup produits de nettoyage.
4. Signes et manifestations cliniques
Le sujet asthmatique présente une réaction immunitaire excessive vis à vis d’un agent extérieur qui s’appelle allergène. L’inhalation de l’allergène provoque une diminution du diamètre des bronches (hyperréactivité bronchique) et une libération de médiateurs chimiques. La fréquence et le degré des symptômes varient largement d’un patient à l’autre et d’un moment à l’autre chez le même sujet. Les symptômes d’asthme peuvent être toujours présents ou se manifester seulement lors d’une exposition aux allergènes.
La crise d’essoufflement aiguë est le symptôme de l’asthme le plus fréquent, mais peut également se traduire par une sensation d’oppression au niveau de la cage thoracique, une difficulté à respirer profondément, une respiration sifflante ou un essoufflement à l’effort. Les manifestations de l’asthme peuvent survenir à n’importe quel moment de la journée, mais elles surviennent surtout en pleine nuit ou au petit matin. L’intensité des symptômes de l’asthme peut être très variable, allant d’une simple gêne à une véritable sensation d’étouffement. (Santé médecine, 2017).
5. Diagnostic
5.1 Diagnostic clinique
L’interrogatoire est l’étape essentielle du diagnostic. Il doit s’attacher à retrouver les symptômes évocateurs d’asthme :
– la respiration sifflante
– la toux
– la sensation d’oppression thoracique
– l’expectoration est souvent blanchâtre, plus ou moins perlée
– le contexte personnel et familial
– l’aggravation des symptômes en présence de certains facteurs ou lors de certaines activités peut être un argument
5.2 Examen physique
Cet examen se fait à l’aide d’un stéthoscope qui permet d’écouter les poumons, et d’examiner les voies nasales.
Figure 3 : stéthoscope (Cosmed, 2007)
5.3 Epreuves fonctionnelles respiratoires
L’épreuve fonctionnelle respiratoire (EFR) est une série d’examens qui permet de mesurer la fonction respiratoire. La plus courante est le test de spirométrie, qui fait appel à un dispositif appelé spiromètre (Figure : 3) pour mesurer la quantité et le débit (écoulement) d’air pénétrant dans les voies respiratoires.
Ce test permet de confirmer le diagnostic d’asthme et d’évaluer la gravité de l’asthme.
Figure 4 : Spiromètre portable moderne (Astra medical, 2017)
Figure 5 : Spiromètre (Cosmed, 2007)
5.4 Radiologie
5.4.1 Radiographie du thorax standard
La radiographie du thorax est un examen qui permet de visualiser le thorax et ses composantes. Elle a pour but d’exclure d’autres maladies associées à l’asthme.
Figure 6 : Photographie du thorax standard (Clinique Croissant Rouge Tétouan, 2017)
5.4.2 Scanner TDM (tomodensitométrie)
Le scanner est une technique d’examen qui permet de réaliser une succession de photographies du poumon, à l’aide d’un appareil à rayons X. Ces photographies permettent dans la plupart des cas de localiser la ou les éventuelles anomalies.
Figure 7 : Photographie du poumon pris par le scanner (Clinique Croissant Rouge Tétouan, 2017)
5.4.3 Autres examens
– Les analyses sanguines peuvent déceler un taux élevé de globules blancs.
– La gazométrie du sang artériel pour mesurer le taux d’oxygène.
– Les analyses sanguines qui mesurent le taux d’anticorps (anticorps IgE) à des allergènes précis.
II. Anatomie de l’appareil respiratoire de l’Homme
L’appareil respiratoire est un ensemble d’organes qui interviennent dans la respiration (échanges gazeux entre l’environnement et l’organisme) et qui permet de l’absorption de dioxygène et du rejet de dioxyde du carbone (Hématose).
On peut distinguer les voies aériennes en deux parties : Les voies aériennes de conductions (nez, pharynx, larynx, trachée et bronche) et les voies aériennes inferieurs qui constituent la plus grande surface d’échanges gazeux (majeur partie des poumons : bronchioles, canaux alvéolaires et alvéoles) (Carillo, 2004).
1. Anatomie de l’appareil respiratoire
Figure 8 : Schéma représentatif de l’appareil respiratoire chez l’Homme (Dannhoffer, 2006)
-Les cavités nasales (fosse nasale) constituent le premier conduit du système respiratoire. Elles sont tapissées de poils et de cils qui permet de filtrer l’air et de le nettoyer.
C’est aussi le lieu de réchauffement et d’humidification de l’air (Croce, 2006).
Figure 9 : Coupe longitudinale d’une cavité nasale de l’Homme (Croce, 2006)
-Le pharynx est un carrefour aéro-digestif. Son rôle est d’obturer la voie aérienne lors de la déglutition.
-Le larynx est la voie respiratoire qui permet le passage de l’air et qui relie le pharynx à la trachée. Il est de structure cartilagineuse.
-La trachée est un conduit cartilagineux qui relie le larynx aux bronches et qui permet le passage de l’air. Elle est composée des anneaux cartilagineux qui ont le but de garder sa forme cylindrique et l’empêcher de s’affaisser sur elle-même.
Les parois internes de la trachée sont recouvertes de mucus et de cils vibratiles, ce qui permet de capter les petits corps étrangers (comme des poussières) et de les faire remonter vers le haut pour protéger les poumons (Carillo, 2004).
-Les poumons sont situés dans la cage thoracique. Ils présentent le lieu où se fait l’échange gazeux (Hématose).
Le poumon gauche comporte deux lobes et celui de droite comporte trois lobes.
L’arbre bronchique a l’aspect d’un arbre inversé qui s’étend de la trachée jusqu’aux alvéoles, en passant par les bronches et les bronchioles.
Figure 10 : Schéma simplifié présente segmentation bronchique.
(Kramer, 2013)
-Les bronches: Le système respiratoire comporte deux bronches principales. Chacune de ces bronches conduit l’air vers l’un des deux poumons. Ces bronches constituent les premières ramifications à l’intérieur des poumons. Il n y a aucun échange gazeux à cet endroit.
La paroi intérieure de ces conduits est pourvue de cartilage et recouverte de mucus et de cils vibratiles régulièrement renouvelés (Dannhoffer, 2006).
-Les bronchioles sont des petits conduits ramifiés qui font partie des bronches et qui permettent d’acheminer l’air de ces derniers aux surfaces d’échange contenues dans les alvéoles.
-Les alvéoles constituent les extrémités des dernières bronchioles, ils ont une forme sphérique qui permet d’augmenter leur surface de contact avec l’air.
L’ensemble des alvéoles forme ce qu’on appel un sac alvéolaire qui est enveloppé d’un tapit de capillaires sanguins. La mince paroi épithéliale des alvéoles et des capillaires ainsi que leur proximité permet d’effectuer les échanges gazeux (Carillo, 2004).
Figure 11 : Représentation schématique des alvéoles
(W Raoul, 2005)
2. Histologie de l’appareil respiratoire
Les voies aériennes sont constituées de trois tuniques concentriques : une muqueuse, un manchon de fibres musculaires lisses et une enveloppe de tissu conjonctif partiellement pourvue de cartilage (Dannhoffer, 2006).
2.1 Musculeuse et tissu conjonctif
2.1.1 Trachées et bronches (extrapulmonaires)
L’armature très développée, est composée d’un empilement de cartilages hyalins, en forme de « fer à cheval » (anneaux trachéaux) dont les bords libres, postérieurs sont reliés entre eux par :
• du Tissu Conjonctif dense, fibreux, inextensible.
• des Fibres Musculaires Lisses, organisées en bandelettes musculaires.
– Le cartilage assure la béance des conduits, ce qui est indispensable à ce niveau de l’arbre bronchique.
– Les fibres musculaires lisses constituent un muscle broncho-constricteur, responsable du tonus broncho-constricteur. Il répond aux sécrétions des cellules des corps neuro-épithéliaux de Lauweryns et règlent le diamètre de la paroi par un ajustement de leur degré de contraction (Carillo, 2004).
2.1.2 Bronches intra-pulmonaires
La structure est globalement conservée, mais avec des adaptations :
• les anneaux sont fragmentés en îlots cartilagineux reliés entre eux par le tissu conjonctif fibreux et les fibres musculaires lisses.
• les bandelettes musculaires tendent à se détacher des structures cartilagineuses et à s’organiser en un anneau.
Cette disposition des pièces cartilagineuses autorise une souplesse tridimensionnelle compatible avec les mouvements du poumon lors des cycles respiratoires (Carillo, 2004).
2.1.3 Bronchioles
Les bronchioles ne possèdent pas du cartilage. Les fibres musculaires lisses sont désormais organisées en un anneau concentrique, capable de régler le calibre des conduits.
Les conduits, dépourvus de cartilage et logés dans le parenchyme pulmonaire, sont sensibles aux « forces de rétraction élastiques » qui modifieraient leur calibre au cours du cycle respiratoire (Carillo, 2004).
2.2 Epithélium et muqueuse
2.2.1 Epithélium
Il est caractérisé par la présence de 2 types cellulaires supplémentaires : la cellule en brosse et la cellule de Clara (Kambouchner, 2013).
• Cellule en brosse : cellule non ciliée avec des microvillosités apicales.
• Cellule de Clara : est une cellule prismatique, sans cils ni microvillosités, présente dans la partie distale de l’arbre bronchique.
– C’est une cellule épithéliale des voies de conduction.
– Elle est capable de sécréter des composants protéiques du surfactant alvéolaire (les apoprotéines).
Epithélium alvéolaire est un épithélium simple, de musculeuse plus en plus réduite (Kambouchner, 2013) et qui est à deux types cellulaires :
– Pneumocyte 1 ou membraneux : est une cellule terminale, pavimenteuse. Ils recouvrent 90% de la surface alvéolaire totale. Ces cellules sont désignées pour faire de la diffusion passive.
– Pneumocyte 2 ou granuleux : est une cellule cubique, arrondie, sans extension cytoplasmique. Sa métabolisme très active a le rôle de : Cellule sécrétrice du surfactant alvéolaire ; Cellule souche de l’épithélium alvéolaire (Carillo, 2004) (Dannhoffer, 2006).
Figure 12 : La paroi des voies aériennes. L’épithélium pseudostratifié des voies aériennes proximales s’affine graduellement et se présente sous la forme d’une couche de cellules cuboïdales dans les bronchioles et très plates dans les alvéoles. L’enveloppe fibreuse se réduit également au fur et à mesure que l’on s’approche des alvéoles. (Dannhoffer, 2006)
2.2.2 Muqueuse
Il forme un revêtement continu tapissant toutes les voies de conduction. On en produit entre 15 et 20 ml par jour. Il provient essentiellement des glandes du chorion. Il a un triple rôle :
1 – Piéger les particules : protecteur contre les agents infectieux, notamment bactériens.
2 – Humidification de l’air inspiré : ceci provient d’une évaporation à partir de la couche superficielle du mucus.
3 – Protection physique des cellules épithéliales : il constitue un enduit recouvrant l’épithélium (Carillo, 2004) (Dannhoffer, 2006).
Figure 13 : Photographie en microscopie optique de cellules humaines bronchiques en culture distinguant une couche de mucus et le liquide périciliaire. Barre d’échelle : 10μm (Dannhoffer, 2006)
III. Etiologie
1. Facteurs impliqués dans le développement et l’expression de la maladie
L’asthme est une maladie multifactorielle. La composante génétique semble complexe et être le résultat de l’association de plusieurs gènes expliquant ainsi l’hétérogénéité clinique de l’asthme. L’asthme est modulé par différents facteurs dont la plupart sont environnementaux. Les allergènes en cause sont nombreux (les acariens, les moisissures, les pollens, les animaux à fourrure, les irritants du milieu professionnel ou encore des allergènes alimentaires), aussi des cofacteurs liés à l’environnement : pollution, fumées, gaz d’échappement, tabagisme…
Certains médicaments dont les antihypertenseurs peuvent jouer un rôle de sensibilisation. D’autres éléments allergisants peuvent être retrouvés tel que les infections virales, un effort important, le stress, l’air froid et sec, les bombes aérosol. Ces facteurs déclenchant sont donc multiples et variés. Ils diffèrent d’un individu à l’autre.
1.1 Facteurs de l’hôte
La prédisposition héréditaire ou l’atopie est le principal facteur causal de l’asthme. Le risque de souffrir d’un asthme est nettement plus élevé chez les personnes ayant un lien de parenté avec des personnes asthmatiques. De plus le terrain génétique est un élément essentiel de la maladie. Des études sur le génome ont mené à l’identification et à la description d’une multitude de gènes de susceptibilité de l’asthme et de réponse aux traitements, qui ont été classés dans 4 groupes distincts (PHAM VAN, 2010). Le premier groupe comprend des gènes associés à l’immunité innée et l’immuno-régulation. Il inclut des gènes de PRR (incluant les TLR2, TLR4, TLR6, TLR10, NOD1 et NOD2), des cytokines régulatrices IL-10 et TGF-β, de facteur de transcription STAT3 et des molécules impliquées dans la présentation antigénique comme le CMH de classe II. Le second groupe comprend des gènes responsables de la différenciation et des fonctions effectrices des cellules Th2, c’est-à-dire les gènes des cytokines IL-4, IL-13, IL- 12p40 et IL-5, le récepteur de l’IgE et des facteurs de transcription Th2. Le troisième groupe implique l’immunité mucosale et épithéliale et inclut des gènes des chimiokines, des substances antimicrobiennes et des molécules impliquées dans l’intégrité de la barrière épithéliale. Les autres gènes de susceptibilité ont été découverts par clonage positionnel. Ils font partie du dernier groupe et sont associés à la fonction pulmonaire, au remodelage tissulaire et à la sévérité de la maladie. En dehors des facteurs génétiques, d’autres facteurs liés à l’hôte ont été associés au développement de l’asthme. Le stress, la prise d’antibiotiques, la vaccination contre les maladies respiratoires, l’obésité et le mode de vie de la mère pendant la grossesse (exemple du tabagisme) (Bouayad & Afif, 1998). De plus des facteurs endocriniens semblent aussi impliqués dans la pathophysiologie de l’asthme (PHAM VAN, 2010).
Les études des familles et les analyses des associations cas-témoin ont identifié un nombre de régions chromosomiques qui sont associées à la susceptibilité de l’asthme (PHAM VAN, 2010).
|
Régions chromosomiques
|
Phénotypes associés
|
|
1 p 32 -3 4
2 p ter
2 q 14
2 q 33
3 q 21
4 q 35
5 p 15
5 q 31 -33
6 p 21 -23
7 p 11
7 p 152
9 q 31
11 p 15
11 q 13
12 q 14
13 q 14
14 q 11 .1
14 q 11 -13
16 p 12
16 q 22 -24
|
Asthme, IgE
Asthme, IgE
Asthme
Asthme
Asthme
HRB
Asthme
Asthme, IgE totals
Asthme, IgE totales et spécifiques, éosinophilie
Asthme
IgE totales, éosinophilie, HRB, asthme
Asthme, IgE spécifiques
Asthme
Asthme, IgE totales, atopie, TC
Asthme, IgE totales
Atopie, asthme, IgE totals
IgE spécifiques, T C
Asthme
IgE totales et spécifiques
IgE totales, HRB, asthme
|
HRB: hyperréactivité bronchique TC: tests cutanés positifs aux principaux pneumallergènes
(PHAM VAN, 2010)
1.2 Facteurs de l’environnement
Quand une personne asthmatique rencontre l’allergène auquel elle est sensibilisés, ses anticorps (IgE) le reconnaissent et déclenchent une réaction allergique au niveau des bronches. Les pneumallergènes (allergènes inhalés) sont très souvent impliqués dans le déclenchement des crises d’asthme. Il peut s’agir d’allergènes per-annuels tels que les acariens de la poussière de maison, les moisissures ou les phanères d’animaux ou d’allergènes saisonniers tels que les pollens.
1.2.1 L’allergie alimentaire
Les sulfites, les agents antioxydants, les conservateurs alimentaires (E220 à E228)… (Michel FB, 1981).
1.2.2 Les allergies professionnelles
Les allergies professionnelles sont non seulement immunogènes, mais ils peuvent aussi intervenir par des mécanismes toxiques, irritatifs ou pharmacologiques (par exemple, isocianate de peinture, boulanger…) (Michel FB, 1981).
1.2.3 Les médicaments
Les médicaments peuvent être responsables d’asthme (Michel FB, 1981)
• AINS et des antihypertenseurs peuvent jouer un rôle sensibilisant.
• Bêtabloquants et sulfites.
• IEC responsable de toux, mais peuvent aussi majorer une HRB.
• Aspirine® entraîne un blocage de la cyclo-oxygénase et dérivant les métabolites de l’acide arachidonique vers les leucotriènes (intérêt des antileucotriènes).
1.2.4 Environnement et pollution
1.2.4.1 Pollution atmosphérique
La pollution atmosphérique est un facteur aggravant indiscutable. Les dioxydes de soufres (SO2) ou d’azote (NO2) ou l’ozone (O3) sont irritants à fortes concentrations pour tout le monde. Ils déclenchent des crises chez les asthmatiques même à faible concentration. (Michel FB, 1981)
1.2.4.2 Pollution domestique
La plupart des habitants du monde occidental, et les enfants passent la majorité de leur temps à l’intérieur des maisons où ils sont exposés à de très nombreux polluants domestiques par exemple : Tabagisme passif ou actif (Tabac). Les parents doivent savoir que la respiration de leurs enfants souffre de leur fumée, non seulement parce qu’elle altère les bronches, mais aussi parce qu’elle favorise l’allergie. (Michel FB, 1981)
1.2.5 Asthme d’effort et asthme à l’air froide
L’asthme d’effort se caractérise par la survenue d’une obstruction bronchique au décours de l’effort ou souvent à l’arrêt de l’effort. L’inhalation d’air froid est asthmogène chez le sujet ayant une hyperréactivité bronchique non spécifique et aurait des caractères proches de l’asthme d’effort (Michel FB, 1981).
1.3 Facteurs psychologique
Les troubles psychologiques sont relativement fréquents dans l’asthme de l’adulte ou de l’enfant, et tout particulièrement lorsque le syndrome est sévère. Leur fréquence n’est pas majorée par rapport aux autres affections chroniques, mais ils modulent souvent le cours de l’asthme (Michel FB, 1981).
IV. Physiopathologie
1. Réaction inflammatoire asthmatique
L’induction d’une immunité implique la génération de réponses distinctes du système immunitaire : la lutte contre les pathogènes intracellulaires est associée à l’activation des macrophages et des lymphocytes CD8+ (réponse Th1); la défense antiparasitaire est liée à la production d’IgE spécifiques et à une inflammation à éosinophiles (réponse Th2). Les lymphocytes CD4+ (TH0) empruntent en effet majoritairement deux grandes voies de différenciation définies par le profil de sécrétion cytokinique. Les lymphocytes Th1 étant caractérisés par la production d’IL-12 et d’interféron (IFN-ɣ) et les lymphocytes Th2 par celle d’IL- 4, d’IL-5 et d’IL-10.
Les lymphocytes Th1 exercent un contrôle négatif sur la différenciation des lymphocytes Th2, et réciproquement (Létuvé & Taillé, 2013) (Bimczok et al., 2006).
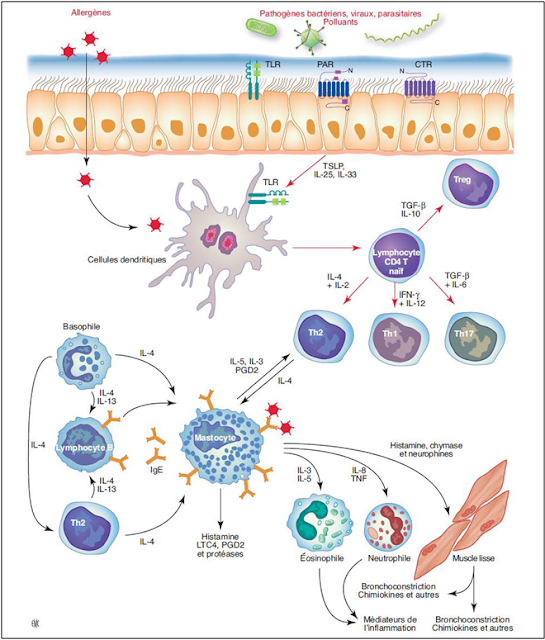
Figure 14 : Initiation et entretien de la réaction inflammatoire dans l’asthme. TLR : Toll like receptors ; PAR : protease-activated receptors ; CTR : Ctype lectin receptors ; TSLP : thymic stromal lymphopoietin ; IL : interleukine ; TGF-_ : transforming growth factor-β ; IFN-_ : interferon _ ; PGD : prostaglandine D ; Ig : immunoglobuline ; LTC4 : leucotriène C4 ; TNF : tumor necrosis factor (Létuvé S & Taillé C, 2013)
La réaction inflammatoire de l’asthme allergique
La physiopathologie de la réaction allergique peut être scindée en trois phases successives. La première est la phase de sensibilisation au cours de laquelle s’instaure la mémoire immunitaire. Dans le cas de l’asthme allergique, la sensibilisation a lieu au niveau des voies respiratoires. L’antigène est pris en charge par les cellules dendritiques (DCs) des voies respiratoires qui sont activées et migrent vers les ganglions médiastinaux qui drainent les poumons. L’antigène est présenté aux cellules T, initiant ainsi la conversion des cellules T CD4 naïves en cellules Th2. Ces cellules Th2 interagissent avec les lymphocytes B et induisent la production des IgE. Ces derniers diffusent localement et gagnent la circulation lymphatique et sanguine pour enfin être distribuées systémiquement. Les IgE spécifiques et non-spécifiques se lient aux récepteurs IgE de haute affinité (FcεRI) à la surface des cellules, plus particulièrement des mastocytes. Cette phase de la réponse allergique est asymptomatique mais elle met en veille un état immunitaire prêt à répondre rapidement en cas de réexposition des voies respiratoires à l’allergène (Létuvé & Taillé, 2013). La Phase effectrice comprend les phases de réaction immédiate et retardée. La phase immédiate a lieu dans les minutes qui suivent une nouvelle exposition à l’allergène contre lequel un individu est sensibilisé. Cette phase se caractérise par l’apparition dans les premières minutes de signes cliniques dépendants du tissu cible (irritation tissulaire, formation d’œdème, sécrétion de mucus et obstruction bronchique marquée due à un spasme du muscle lisse bronchique). Durant cette phase, l’allergène est reconnu par des IgE spécifiques, liés aux FcεRI à la surface des mastocytes et des basophiles. Le complexe IgE/allergène induit l’agrégation des récepteurs, activant les mastocytes et les basophiles qui libèrent immédiatement le contenu de leurs granules cytoplasmiques. Il s’agit des molécules vaso-actifs (les leukotriènes, l’histamine, les prostanoïdes) ou cytokiniques et chimiotactiques (Létuvé & Taillé, 2013). Ces derniers induisent une vasodilatation et une bronchoconstriction et augmentent la production de mucus par les cellules caliciformes et la perméabilité vasculaire.
Outre leur rôle dans la réaction immédiate, les mastocytes contribuent à la transition vers la réaction retardée en initiant le recrutement de cellules inflammatoires. La phase tardive se déclare après 6-12 heures et s’éteint dans les 12-24 heures. Elle est caractérisée par l’infiltration des tissus enflammés par plusieurs types cellulaires dont les éosinophiles, les lymphocytes T et les basophiles. Ces cellules libèrent à leur tour des substances proinflammatoires cytotoxiques, telles que les protéines des granules des éosinophiles (Major Basic Protein : MBP), (Eosinophil Peroxydase : EPO) responsables de la destruction de l’épithélium et de l’inflammation de la sous-muqueuse, diminuant alors le diamètre des voies aériennes. Les sous populations lymphocytaires T auxiliaires majoritairement Th2 interviennent dans le recrutement des cellules effectrices et dans l’activation de l’épithélium bronchique. Cette inflammation est chronique et aboutit à long terme à une modification de l’architecture des voies respiratoires, également nommée remodelage bronchique. Ce dernier se caractérise par une desquamation de l’épithélium, une métaplasie des cellules caliciformes, un épaississement de la membrane basale et une hyperplasie des cellules musculaires lisses.
1.1 Acteurs cellulaire
Cellules épithéliales des voies respiratoires
Un épithélium est formé de cellules jointives, juxtaposées, solidaires les unes des autres par un système de jonctions et séparées du tissu conjonctif sous-jacent par une lame basale.
L’épithélium des voies respiratoires est capable de se défendre face aux diverses agressions quotidiennes. Pour cela, il dispose dans un premier temps d’un système de défense inné, basé sur des propriétés physiques et antimicrobiennes.
Les cellules épithéliales peuvent recruter des cellules phagocytaires, en premier lieu des granulocytes et secondairement des cellules de l’immunité, et ainsi une réponse inflammatoire est mise en place (TARONT, 2008), et tous ça est grâce à leurs capacités de produire des cytokines et de certaines médiateurs qui ont l’effet de modulation des fonctions des cellules de l’immunité et en particulier les cellules dendritiques, cellules présentatrices d’antigènes professionnelles, et les lymphocytes (TARONT, 2008).
Ces cytokines et ces médiateurs (GM-CSF, IL-8, IL-6, prostaglandin 2 …) se produisent après un dommage des cellules épithéliales où il aura aussi une production de facteurs de croissance dont les effets cumulatifs constituent des changements structuraux caractéristiques de l’asthme (PHAM VAN, 2010).
Ces cellules peuvent êtres directement impliquées dans le développement des manifestations d’asthme indépendamment des cellules Th2 (PHAM VAN, 2010).
Dans le sujet non asthmatique l’épithélium forme une barrière très stricte presque imperméable et présente une grande capacité de réparation en cas de blessure, mais chez le sujet asthmatique l’épithélium bronchique est plus fragile, avec une perte facile de cellules cylindriques. La perméabilité de l’épithélium asthmatique est augmentée, conduisant à un meilleur accès des allergènes inhalés, des polluants, et d’autres irritants pour les cellules basales et les tissus des voies respiratoires sous-jacentes (PHAM VAN, 2010).
Cellules dendritiques
Les cellules dendritiques (DCs, dendritic cells) sont des cellules sentinelles caractérisées par la présence de PRRs, de TLR et de longs prolongements cytoplasmiques, rappelant les dendrites des neurones (dendron, du grec, arbre). Elles sont des cellules CPA capables d’activer les LT naïfs et du maintien de la tolérance au soi et font le lien entre l’immunité innée et l’immunité adaptative (GALMÈS, 2013) et aussi capables de polariser la réponse induite par l’antigène. Tous ces effets se font grâce à la capacité de ces cellules de produire des cytokines après leurs activation par phagocytose de l’agent pathogène, où elles vont secréter différentes cytokines comme l’INF-ɣ et l’IL-6 qui orienteront essentiellement les lymphocytes vers une réponse cellulaire de type Th1, et les cytokines IL-4, IL-5, IL-10 et IL-13 vers une réponse humorale de type Th2. Ces cytokines vont également permettre le recrutement des PNN et des macrophages (GALMÈS, 2013).
Les cellules dendritiques sont présentes en nombre plus important dans les bronches d’asthmatiques et expriment des marqueurs d’activation. Elles constituent le « réseau sentinelle » de la muqueuse bronchique et sont capables de capturer les aéroallergènes grâce à des extensions cellulaires situées en surface de l’épithélium (Létuvé & Taillé, 2013), et quand elles sont activées elles migrent rapidement vers les ganglions lymphatiques, ce qui leur confère un rôle majeur dans l’initiation de la réponse locale aux antigènes inhalés, et notamment dans la différenciation Th2 des lymphocytes CD4+ activés (Létuvé & Taillé, 2013). La synthèse de chimiokines par les cellules dendritiques permet de plus le recrutement ciblé des cellules de l’immunité vers le site d’entrée de l’allergène, facilité par l’augmentation locale de la perméabilité vasculaire (Létuvé & Taillé, 2013).
Mastocytes
Les mastocytes (mast = grasse en allemand) sont présents dans la plupart des tissus bordant les vaisseaux sanguins (tissu conjonctif et muqueuses). Ils contiennent de nombreux granules riches en médiateurs de l’inflammation.
Ils jouent un rôle majeur dans la phase aiguë du processus inflammatoire dans l’asthme. L’activation des mastocytes, en particulier par leur récepteur de haute affinité des IgE (FcεRI), conduit à la dégranulation et la libération de plusieurs médiateurs inflammatoires dont l’histamine qui peut être directement impliquée dans la contraction du muscle lisse bronchique (broncho-constriction) et l’augmentation de la perméabilité vasculaire et microvasculaire (Létuvé & Taillé, 2013). Les mastocytes peuvent également être activés par d’autres mécanismes indépendants des IgE, tels FcɣR1 (récepteur du complément), les TLR et l’IL-33. Cette activation générale des mastocytes contribuerait à la majoration d’une hyperréactivité bronchique et à une inflammation chronique, y compris à l’infiltration des éosinophiles, des neutrophiles, des cellules dendritiques et des lymphocytes CD4+ (PHAM VAN, 2010). Enfin, les mastocytes pourraient participer à la présentation antigénique : leur activation par les IgE spécifiques conduit à leur apoptose puis leur phagocytose par les cellules dendritiques. L’incorporation des antigènes ingérés pourrait ensuite participer à la propagation de la réponse des lymphocytes CD4+ (Létuvé & Taillé, 2013).
Basophiles
Les basophiles sont des granulocytes qui proviennent des progéniteurs CD34+. Ils complètent leur maturation dans la moelle osseuse puis en sortent sous leur forme mature. Ils sont riches en granules basophiles et ils ont les mêmes précurseurs sanguins que les mastocytes tissulaires. Dans les tissus, les basophiles sont très peu présents. Ils ont une demi-vie courte de quelques jours environ (PHAM VAN, 2010). Les basophiles sont morphologiquement et fonctionnellement très semblables aux mastocytes résidantes des tissus. Les basophiles circulants expriment divers récepteurs incluant des récepteurs de cytokines (récepteurs pour l’IL-2, l’IL-3, l’IL-4, l’IL-5 et l’IL-33), de chimiokines (notamment CCR2, CCR3), du complément, de facteurs de croissance et des récepteurs aux Fc des Ig (Ait Yahia-Sendid S, 2012). Les basophiles, comme les mastocytes, participent à l’initiation de l’inflammation allergique, par l’intermédiaire de la fixation des IgE spécifiques sur le récepteur FCɛR1. Ils sont également impliqués dans la différenciation Th2 des lymphocytes T, via leur sécrétion d’IL-4 et d’histamine qui inhibe lui même la réponse Th1, et ils ont un effet sur les cellules Th2 mémoires par la sécrétion de l’IL-25 (PHAM VAN, 2010). La production d’IL-4 et d’IL-6 par les basophiles contribue de plus à la réponse humorale aux stimulations antigéniques répétées, en favorisant la prolifération des lymphocytes B et la production des anticorps (Ait Yahia-Sendid S, 2012).
Eosinophiles
L’inflammation qui se produit dans l’asthme est souvent décrite comme éosinophilique. Les éosinophiles sont présents non seulement dans la paroi des voies respiratoires, mais aussi dans l’asthme mal contrôlé dans les expectorations et le liquide de lavage bronchoalvéolaire (Ait Yahia-Sendid S, 2012).
Les éosinophiles renferment de grosses granulations éosinophiles avec des protéines basiques majeures et une péroxydase. La membrane plasmique est riches en récepteurs pour les PAMPs, le C3b, le fragment Fc des Ig et l’histamine.
Une fois les cytokines et les chimiokines présents dans les tissus, les éosinophiles contribuent à la manifestation des symptômes par le relargage de leurs granules contenant différents médiateurs proinflammatoires comme MBP (major basic protein), ECP (eosinophil cationic protein), EDN (eosinophil-derived neurotoxin) et EP (eosinophil peroxydase). La MBP provoque une dégranulation des mastocytes et la libération d’histamine et de leucotriènes qui, à leur tour, vont causer une bronchoconstriction. Il a été récemment démontré que l’EDN des éosinophiles modulait les DC pour amplifier la réponse Th2 en stimulant TLR2 (PHAM VAN, 2010).
À l’activation, les éosinophiles libèrent des superoxydes qui potentiellement induisent des lésions tissulaires et également des cytokines et des chimiokines (PHAM VAN, 2010).
Neutrophiles
Chez l’homme, les neutrophiles semblent impliqués dans la réaction allergique, et plus particulièrement dans l’asthme sévère. Les neutrophiles activés pourraient produire des médiateurs moléculaires impliqués dans la réaction pulmonaire allergique tels que les lipides (LTA4, LTB4, PAF…) les cytokines (IL-1β, IL-6, TNF- α, TGF-β, CXCL8), les protéases (élastase, collagènase…) et les dérivés oxygénés. L’ensemble de ces produits participerait à l’amplification de la réaction locale et pourrait causer le rétrécissement des voies aériennes et la sécrétion de mucus (Ait Yahia-Sendid S, 2012).
Monocytes et macrophages
Le nombre des monocytes et des macrophages dans les poumons des patients atteints d’asthme est augmenté. Ils sont dérivés de monocytes circulants qui migrent vers les poumons en réponse à l’action chimiotactique des chimiokines. Dans l’asthme réfractaire à la corticothérapie, les monocytes et les macrophages sont considérés comme ayant un rôle important (PHAM VAN, 2010).
Lymphocytes T
On a longtemps pensé que l’anomalie princeps qui conduisait à l’asthme résidait dans un déséquilibre entre les réponses Th1 et Th2. Cependant, dans les modèles animaux d’asthme allergique, les lymphocytes Th1 ne sont ainsi pas toujours protecteurs et l’IFN-ɣ, cytokine Th1, est également produite au cours de la sensibilisation allergique. La découverte du rôle des sous-populations lymphocytaires Th17, Treg et natural killer (NK)-T démontre à présent que le paradigme Th1/Th2 ne peut à lui seul rendre compte de la complexité de la réponse inflammatoire dans l’asthme (Létuvé & Taillé, 2013).
• Lymphocytes Th2
Les cellules Th2 jouent un rôle central dans l’inflammation allergique. Une fois l’activation de ces cellules est mise en place, l’expression des gènes codants à l’IL-3, IL-4, IL-5, IL-9, IL-13 et GM-CSF augmente.
Ces cytokines sont impliquées dans la commutation de classe d’immunoglobulines des cellules B vers la synthèse d’IgE (IL-4 et IL-13), le recrutement des mastocytes (IL-4, IL-9 et IL-13), et la stimulation, maturation des éosinophiles (IL-3, IL-5 et GM-CSF) et des basophiles (IL-3), cellules effectrices essentielles de la réponse allergique. Les cellules Th2 différenciées sont recrutées dans le site inflammatoire par la production des chimiokines (PHAM VAN, 2010).
• Lymphocytes Th17
Les lymphocytes Th17, qui produisent de l’IL-17A, IL-17F, IL- 22, IL-21 et TNF, participent à la défense contre les pathogènes extracellulaires (bactériens) et l’infection fongique et sont en particulier impliqués dans l’auto-immunité. Ils ont également été détectés dans les biopsies bronchiques d’asthmatiques. Outre les cellules Th17, les sources d’IL-17 incluent les lymphocytes Tɣδ, les cellules NK, les neutrophiles et les macrophages. L’expression de l’IL-17 est associée avec la présence de neutrophiles au niveau des voies aériennes et à l’importance de l’hyperréactivité bronchique. Les Th17 majorent l’inflammation éosinophile bronchique induite par les antigènes (Létuvé & Taillé, 2013).
• Lymphocytes T régulateurs
Les Treg dites naturelles constituent 5 à 10% des lymphocytes CD4+ de la périphérie. Ces cellules expriment constitutivement et fortement la molécule CD25 (cellules T CD25high), la molécule CTLA-4 (cytotoxic T-lymphocyte antigen-4), le GITR (glucocorticoid-induced tumor necrosis factor receptor) et le facteur de transcription Foxp3 (forkhead box protein 3).
Contrairement aux autres cellules T CD4+, ces cellules ne prolifèrent pas et ne produisent pas de cytokines lorsqu’elles sont stimulées avec un antigène in vitro, mais elles suppriment la prolifération et la production de cytokines par d’autres cellules T appelées effectrices. Ce pouvoir se réalise par ces cellules grâce à ses capacités de l’expression du « facteur de transcription FoxP3 ».
L’expression du facteur FoxP3 est lui-même inhibé par l’expression du facteur de transcription des Th1 T-bet ou du facteur de transcription des Th2.
A la différence des effets des lymphocytes T régulateurs naturels non spécifiques de l’allergène, les lymphocytes T régulateurs dits “induits” limiteraient les réponses allergiques par des actions spécifiques de l’allergène (PHAM VAN, 2010).
Lymphocytes NKT
Les lymphocytes NK invariants (iNK-T) produisent les cytokines IL-4 et IFNɣ en forte quantité, régulant la fonction d’un grand nombre de cellules comme les cellules dendritiques, les lymphocytes B et les lymphocytes T « conventionnels ». Néanmoins, leur implication dans le développement de l’asthme fait l’objet de discussions. Enfin, la présence de cellules CD8+ au niveau des voies aériennes des sujets asthmatiques, atopiques ou non atopiques, est bien documentée. Ces cellules produisent d’ailleurs alors des quantités augmentées d’IL-4, d’IL-5 et d’IFN-ɣ (Létuvé & Taillé, 2013).
Lymphocytes B
Les lymphocytes B jouent un rôle important dans les maladies asthmatiques. Ils interviennent à la synthèse des IgE spécifiques aux allergènes sous l’influence des réponses dérégulées à cellules Th2. Chez l’homme, l’IL-4, induit la commutation vers l’IgE et vers un isotype d’IgG (IgG4) qui interagit d’une manière peu efficace avec les récepteurs FcεRI et active faiblement le complément. Le contact avec l’allergène dans la phase de sensibilisation induit la synthèse par les cellules B des anticorps IgE spécifiques de l’allergène. Cette phase met de deux à trois semaines pour se développer pleinement. Ces anticorps se fixent rapidement à leurs récepteurs de haute affinité (FceRI) présents essentiellement sur les mastocytes et les basophiles (Ait Yahia-Sendid S, 2012).
Lorsque contact ultérieur avec l’allergène inhalé est mise en place, la réponse est déclenchée par le pontage des molécules d’IgE liées aux FceRI, ce qui entraine la dégranulation immédiate des mastocytes et des basophiles avec libération des médiateurs dont l’histamine et de protéases suivie par la synthèse et la libération des médiateurs lipidiques et des cytokines inflammatoires peu de temps après (Figure 10). La réponse inflammatoire précoce provoque le recrutement de nombreuses populations cellulaires, y compris les basophiles, les éosinophiles et les cellules Th2 aux sites inflammatoires (PHAM VAN, 2010).
Figure 15: L’activation des mastocytes déclenche une réaction allergique
(PHAM VAN, 2010)
1.2 Médiateurs de l’inflammation asthmatique
Lors de l’inflammation, les cellules de l’immunité impliquées dans la réponse sécrètent plusieurs médiateurs.
• Histamine
L’histamine est sécrétée essentiellement par les basophiles et les mastocytes. Par son action directe sur les récepteurs H1 exprimés sur les cellules musculaires lisses il conduit à une bronchoconstriction puissante. Elle entraîne aussi une extravasation vasculaire également dépendante des récepteurs H1, et par conséquent, un œdème muqueux qui participe à l’obstruction bronchique (Ait Yahia-Sendid S, 2012).
• Chimiokines
Le recrutement de cellules inflammatoires dans les voies respiratoires par des chimiokines est un processus essentiel au développement de l’asthme.
L’expression de CCR3 par les mastocytes, les basophiles, les éosinophiles et les cellules Th2 et la production de ses ligands, CCL11 (éotaxine), CCL24 (éotaxine-2), et CCL26 (éotaxine-3), sont augmentées dans l’asthme et sont impliquées dans le recrutement des éosinophiles (PHAM VAN, 2010).
CCR4 est exprimé essentiellement sur des cellules Th2, Th17, des cellules NKT et des basophiles. Le nombre de cellules Th2 exprimant CCR4 ainsi que l’expression de ses deux principaux ligands CCL17 (TARC) et CCL22 (MDC) dans les voies aériennes asthmatiques sont augmentés après stimulation allergénique (PHAM VAN, 2010).
CCR5 fonctionne comme un récepteur de chimiokine exprimé principalement sur les lymphocytes Th1, les macrophages, les cellules dendritiques mais aussi les cellules NKT (PHAM VAN, 2010).
CCR8 est exprimé sur les cellules Th2. Les souris déficientes en CCR8 ont une forte réduction de l’infiltration des éosinophiles et une diminution de l’hyperréactivité bronchique induite par les allergènes (PHAM VAN, 2010).
CRTH2 (chemoattractant receptor-homologous molecule expressed on TH2) est exprimée sur les cellules Th2, les mastocytes, les basophiles, les éosinophiles, il sert ainsi de médiateur pour la migration de ces cellules vers les sites inflammatoires (PHAM VAN, 2010).
CXCL8 (IL-8) est une chimiokine importante pour la chimiotaxie et l’activation des neutrophiles, et des macrophages (PHAM VAN, 2010).
CCR2, qui est exprimé sur les monocytes et les lymphocytes Th2, les mastocytes, une sous-population de lymphocytes Th17, et à un faible niveau sur les cellules NKT, est aussi une cible pour la thérapeutique dans l’asthme (PHAM VAN, 2010).
Figure 16 : L’expression de CCR3, CRTH2, CCR4, CCR5, CCR8, CCR2 et CXCR1/CXCR2 sur les principaux acteurs cellulaires impliqués dans l’inflammation asthmatique (PHAM VAN, 2010)
• Cytokines
L’IL-33 induit la sécrétion d’IL-5 et d’IL-13 par les lymphocytes Th2 activés mais peut également polariser des lymphocytes T naïfs en cellules productrices d’IL-5, active les mastocytes et les basophiles, et favorise l’inflammation à éosinophiles en augmentant leur survie. Elle peut également induire une réponse de type Th1. Dans les modèles animaux, l’IL-33 favorise le développement d’une hyperréactivité des voies aériennes. À l’inverse, l’injection d’anticorps bloquant l’IL-33 réduit l’infiltration éosinophile, la production de cytokines Th2 et le remodelage bronchique. Chez l’homme, l’expression d’IL-33 est augmentée chez les asthmatiques, notamment les plus sévères (Létuvé & Taillé, 2013).
L’IL-25 se produite par les éosinophiles, les basophiles, les mastocytes, les macrophages et les lymphocytes T favorise le développement des réactions allergiques et de l’hyperréactivité des voies aériennes ainsi que le remodelage tissulaire en activant les réponses immunes à la fois adaptative et innée. L’IL-25 est capable de provoquer une hyperréactivité des voies aériennes chez des souris rendues déficientes en cytokines Th2 (Létuvé & Taillé, 2013).
L’IL-4 est impliqué dans la polarisation de la réponse humorale. Elle permet avec l’IL-13 l’activation de la commutation de classe, et stimule donc la synthèse des IgG1 et IgE, alors qu’il inhibe la synthèse des IgG2a, IgG2b, IgG3 et IgM (Ait Yahia-Sendid S, 2012).
L’IL-13 agit sur les macrophages tissulaires en inhibant la production de cytokines pro-inflammatoires de type IL-12, IL-8 et IL-6, mais inhibe également l’IL-10. Ce mécanisme permet de bloquer le développement d’une réponse de type Th1 antagoniste et amplifie la réponse Th2. IL-13 agit également au site inflammatoire sur les cellules tissulaires, par exemple sur l’épithélium bronchique, en favorisant la sécrétion de mucus par les cellules calciformes et en potentialisant l’hyperréactivité bronchique par une action sur les cellules musculaires lisses péribronchiques (Ait Yahia-Sendid S, 2012).
2. Hyperréactivité et obstruction bronchique
L’hyperréactivité bronchique (HRB) est une caractéristique majeure de l’asthme et se définit comme une réponse exagérée des bronches vis-à-vis de stimuli n’ayant pas d’effet chez le sujet sain. La preuve de l’HRB peut être apportée en soumettant les bronches du sujet à une stimulation contrôlée, reproductible, connue pour ne déclencher aucune réaction chez le sujet sain. Il existe une certaine corrélation entre la sévérité de la maladie asthmatique et l’ampleur de l’HRB. L’HRB peut augmenter de deux à quatre doses doublantes lors de l’exposition allergénique chez le patient sensibilisé et diminue en moyenne de deux doses doublantes de métacholine sous corticothérapie inhalée (C. Barnig & Blay, 2013).
Une hypertrophie des glandes séro-muqueuses est retrouvée dans l’asthme et conduit à une hypersécrétion de mucus, qui majore l’obstruction bronchique et l’HRB (OZIER A, 2011). Parmi les mécanismes responsables de cette hypertrophie (connus à l’heure actuelle) :
• Les neutrophiles activés pourraient produire des médiateurs moléculaires (LTA4, LTB4, PAF…) des cytokines (IL-1β, IL-6, TNF- α, TGF-β, CXCL8), des protéases (élastase, collagènase…) et des dérivés oxygénés. L’ensemble de ces produits participerait à l’amplification de la réaction locale et pourrait causer le rétrécissement des voies aériennes et la sécrétion de mucus (Ait Yahia-Sendid S, 2012).
• L’IL-13 est une cytokine produite par les Lymphocytes Th2. Elle a un rôle crucial dans la phase effectrice de l’asthme allergique dans les modèles expérimentaux. De plus, l’injection d’IL-13 recombinante ou sa surexpression dans les poumons de souris induit le développement d’un asthme très similaire à celui observé chez l’Homme, caractérisé par une inflammation éosinophilique, une hyperréactivité bronchique, une hyperplasie des cellules productrices de mucus et une fibrose sous-épithéliale (Virginie Robert, 2012).
Figure 17: Rôle des lymphocytes Th2 dans la physiopathologie de l’asthme. L’IL-13, comme l’IL-4 agit sur les LB et a également un effet sur l’épithélium bronchique où elle entraîne une hypersécrétion de mucus conduisant à une hyper-activité bronchique. (Virginie Robert, 2012)
• L’IL-17 était décrite comme une puissante cytokine pro-inflammatoire agissant sur les cellules épithéliales, endothéliales, stromales et monocytaires en induisant la sécrétion de médiateurs inflammatoires comme CXCL8 (IL-8), CXCL1, TNF-alpha et des facteurs de croissance (Chesné et al., 2013). Ces effets contribuent à l’amplification des réponses inflammatoires par l’attraction des cellules immunitaires notamment des granulocytes (éosinophiles, neutrophiles) sur le site de l’inflammation (Chesné et al., 2013).
• L’histamine est sécrétée essentiellement par les basophiles et les mastocytes. Par son action directe sur les récepteurs H1 exprimés sur les cellules musculaires lisses il conduit à une bronchoconstriction puissante. Elle entraîne aussi une extravasation vasculaire également dépendante des récepteurs H1, et par conséquent, un œdème muqueux qui participe à l’obstruction bronchique. Il conduit aussi à l’augmentation de la sécrétion de mucus (Ait Yahia-Sendid S, 2012).
• IL-13 agit au site inflammatoire sur les cellules tissulaires, par exemple sur l’épithélium bronchique, en favorisant la sécrétion de mucus par les cellules calciformes et en potentialisant l’hyperréactivité bronchique par une action sur les cellules musculaires lisses péribronchiques (Ait Yahia-Sendid S, 2012).
Figure 18 : Différents types d’activation T dans l’asthme (Chesné et al., 2013)
Figure 19: Coupe schématique d’une bronche d’un patient asthmatique (Pham V, 2010)
V. Conclusion
Aujourd’hui l’asthme constitue le majeur problème de la santé où elle devient plus fréquents dans les payées industrialisés. Cette prévalence augmente à cause de plusieurs facteurs tels que la pollution atmosphérique ce qui conduit à un déclenchement d’une inflammation chronique au niveau des voies respiratoires par l’intervention de plusieurs cellules de l’immunité. Ces cellules provoquent une libération des médiateurs chimiques de l’inflammation, ce qui fait l’apparition des lésions tissulaires et des signes cliniques. Comme solution il est préférable de diagnostiquer la maladie afin de savoir l’allergène dans lequel le sujet est sensibilisé pour l’évité en premier temps, et en deuxième temps pour choisir le médicament efficace.
Bibliographies
A
Acouetey D S & Ardoin, 2012. Determinants genetiques, nutritionnels et metaboliques de l’asthme professionnel. Ecole Doctorale BioSE (Biologie-Santé-Environnement), Faculté de Médecine -BP 184, 54511 Vandœuvre-lès-Nancy, 6:352
Ait Yahia-Sendid S, 2012. Chimiokines et interaction entre immunité innée et adaptative dans l’asthme allergique : implication des cellules dendritiques et du récepteur NOD1. Université du Droit et de la Santé de Lille 2, 184p
Ameille. J, 2010. Les principaux métiers en cause. Asthme professionnel. Fiche pratique 2, Info Respiration, 11p
Andrew & Lumb, 2017. Functional Anatomy of the Respiratory Tract, ln Andrew, Lumb Eds. NUNN’S APPLIED RESPIRATORY PHYSIOLOGY. Elsevier, USA
Astra medical, 2017. Spiromètre de table diagnostic des troubles respiratoires. Disponible sur (http://www.asmed.dz/spirometre-spirolab.html); consulté le 19-06-2017
B
Bardei. F a,*, Bouziane. H a, Kadiri. M a, B. Rkiek b, A. Tebay b, A. Saoud b , 2016. Profils de sensibilisation cutanée aux allergènes respiratoires des patients de la ville de Tétouan (Nord Ouest du Maroc). Revue de Pneumologie clinique, 72 :221-227
Barnig. C & Blay, 2013. Mesurer l’hyperréactivité bronchique : quel intérêt pratique ?. Revue française d’allergologie 53 : 117–118
Bimczok D et al., 2006. Phenotype and distribution of dendritic cells in the porcine small intestinal and tracheal mucosa and their spatial relationship to epithelial cells. Cell Tissue Res, 325:461-8.
Bouayad Z & Afif H, 1998. L’épidémiologie de l’asthme et de la rhinite dans les pays au sud de la méditerranée. Rev Fr Allergo, 38 : 154-9.
C
Carillo, 2004. Histologie de l’appareil respiratoire – Voies aériennes profondes. Faculté de Médecine Montpellier-Nîmes, 31p
CHESNÉ. J a,*,b, F. BRAZA a,b,c, A. MAGNAN a, , 2013. Th17, neutrophils and bronchial hyperreactivity. 53:104-107
Clinique Croissant Rouge – Tétouan, 2017
Cosmed, 2007. Spiromètre portable moderne. Disponible sur (https://fr.wikipedia.org/wiki/Spirom%C3%A8tre); consulté le 19-06-2017
Croce, 2006. Etude Numerique Et Experimentale De L’ecoulement Nasal Dans Des Geometries Realistes. Universite Paris Xii – Val De Marne, 231p
D
Dannhoffer, 2006. Transports Ioniques Transépithéliaux Dans Les Voies Aériennes Humaines Non-Mucoviscidosiques Et Mucoviscidosiques. Université Paris XII Val de Marne, 231p
E
El Yamani Mounia, 2003. Asthme, allergies et maladies respiratoires Asmanet Association Asthme&Allergies (Disponible sur www.remcomp.com/asmanet/asthme/index.html) ; consulté le 04-04-2017
G
GALMÈS. J, 2013. Isolement et caractérisation de nouvelles espèces de Torque Teno Mini Virus (TTMV) : implication potentielle dans la pathogenèse de la pneumonie. École Normale Supérieure de Lyon, Université de Lyon, 179p
Godard. P, J Ameille, Jean-Claude Pairon, 2004. Handicap respiratoire d’un asthmatique au travail. Asthme Professionnel. 3 :11. Editions Imothep, Paris
K
Kambouchner, 2013. Voies aériennes distales : histologie normale et lésions anatomopathologiques. Revue des Maladies Respiratoires 30 :286-301
Kramer, 2013. Fonctionnement normal des voies respiratoires. Disponible sur (http://tout-sur-l-asthme.blogspot.com/p/fonctionnement-normal-des-voies.html); consulté le 10-05-2017
L
Létuvé S & Taillé C, 2013. Physiopathologie de la réponse inflammatoire dans l’asthme de l’adulte. EMC – Pneumologie, 10:1-8
N
Nafti. S, Taright. S, El Ftouh. M, N. Yassine, A. Benkheder, H. Bouacha, M. Ali-Khoudja, H. Fakhfakh, S. Schück, N. Texier, A. El Hasnaoui, 2009. Prévalence de l’asthme dans les pays du Maghreb : étude AIRMAG. Disponible sur (http://www.em-premium.com/rmr/article/196592) ; consulté le 08-06-2017
O
Organisation Mondiale de la Santé, 2017. Asthme. Disponible sur (http://www.who.int/mediacentre/factsheets/fs307/fr/) ; consulté le 08-06-2017
OZIER A, 2011. Étude Physiopathologique De L’inflammation Et Du Remodelage Bronchique Dans L’asthme. Université Victor Segalen Bordeaux 2, 331p
P
PHAM VAN, 2010. Modulation de la réponse immunitaire par des agonistes de la voie de signalisation TLR/IL-1R dans le modèle d’asthme. Ecole Doctorale, Universite Paris Descartes, 260p
R
Raoul. W, 2005. Effets des facteurs angiogéniques et des cellules progénitrices dans la réparation de la barrière alvéolo-capillaire au cours des agressions pulmonaires aiguës. Université Paris XII-Val de Marne, 193p
S
Sanchez. M, 2015. Évolution de l’asthme au long cours : Aspects méthodologiques et lien avec la pollution atmosphérique. ÉCOLE DOCTORALE 420 : SANTÉ PUBLIQUE PARIS SUD 11, PARIS DESCARTES, UNIVERSITÉ PARIS-SUD, 19 : 155
Santé médecine, 2017. Asthme – Symptômes et traitement. Disponible sur (http://sante-medecine.journaldesfemmes.com/contents/70-asthme-symptomes-et-traitement); consulté le 23-03-2017
T
TARONT, 2008. Interactions Entre Epithelium Bronchique Et Cellules Dendritiques : Implication De Molecules Membranaires. Université du Droit et de la Santé de Lille II, 179p
V
Virginie Robert, 2012. Implication des canaux CaV1 dans la signalisation calcique des lymphocytes Th2 murins et humains : possibles applications thérapeutiques dans l’asthme. Universite De Toulouse III Paul Sabatier, 184
_____________________________________________________
Merci de votre lecture
.
Télécharger la forme Pfd
.



Bon courage 🙂
Merci 😉